Лабораторные работы по теме: Метод абсорбционной спектроскопии
Лабораторные работы по теме: Метод абсорбционной спектроскопии
2. Лабораторная работа. Определение железа (III) в растворе методом добавок
Абсорбционный фотометрический анализ
Оглавление
Теоретическая часть [ссылка]
Экспериментальная часть
Цель работы: определить массу железа (III) в выданном растворе методом добавок на фотоэлектроколориметре КФК-2.
Приборы и реактивы:
Фотоэлектроколориметр КФК – 2, 2 мерные колбы объемом 100 мл, содержащие анализируемый раствор соли железа (III), кюветы с рабочей поверхностью 50 мм, раствор азотной кислоты, раствор серной кислоты, раствор сульфосалициловой кислоты, дистиллированная вода.
Железо (III) образует с сульфосалициловой кислотой ряд комплексных соединений в зависимости от кислотности раствора.
1. При рН 1,8-2,5 образуется комплексное соединение фиолетового цвета, имеющее состав 1:1. Моносульфосалицилат железа имеет λ = 510 нм и молярный коэффициент поглощения ε510= 1,8*103
2. При увеличении рН до 4-8 образуется комплексное соединение, имеющее состав 1:2.
3. При рН 9-11,5 образуется комплекс состава 1:3, растворы которого окрашены в желтый цвет. Трисульфосалицилат железа имеет λ = 416 нм молярный коэффициент поглощения ε416= 5,8*103
При рН больше 12 происходит разложение комплексного соединения с выделением в осадок гидроксида железа (III) .
Железо (III) не дает с сульфосалициловой кислотой интенсивной окраски, но вследствие легкой окисляемости железа (II) в железо (III) в щелочной среде можно определять сумму железа (II) и железа (III). Комплексные соединения железа с сульфосалициловой кислотой более устойчивы, чем роданидные комплексы железа, что позволяет применять рассматриваемый метод для определения железа в присутствии фосфатов, ацетатов и боратов.
В присутствии магния, алюминия, марганца и некоторых других элементов более применим способ определения железа в кислой среде.
Сульфосалициловая кислота.
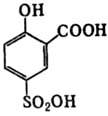
*2 Н2О
М=254 г/моль
Β(FeL3 6)=3, 98*1032 , где Β(FeL)=1, 05*1015
Для определения концентрации железа (III) измеряют оптические плотности испытуемого раствора и испытуемого раствора с добавкой стандартного раствора. В качестве раствора сравнения используют растворитель. Расчет концентрации испытуемого раствора проводят по формуле.
Измерение оптической плотности проводят на фотоэлектроколориметре.
Принцип работы фотоэлектроколориметра КФК-2 [ссылка]
Порядок выполнения работы
1. Приготовление стандартного раствора соли железа
Навеску железоаммонийных квасцов NH4Fe(SO4)2 * 12 H2O массой 0,8640 г переносят в мерную колбу вместимостью 1000 мл, растворяют, приливают 25 мл концентрированной азотной кислоты (пл. 1,19 г/см3) и доводят водой до метки. В 1 мл этого раствора содержится 0,1 мг (концентрация раствора равна 0,0001 г/мл) иона Fe3+.
Расчет:
m (Fe) = m (навески) *((М (Fe) / M (NH4Fe(SO4)2 * 12 H2O)) (1)
m (Fe) = 0,8640 * (55,85 / 481,85) = 0,1 г (масса Fe, содержащаяся в 1 литре раствора).
Отсюда в 1 мл раствора содержится 0,0001 г Fe (или 0,1 мг).
2. В мерную колбу объемом 100 мл, содержащую анализируемый раствор (выдается лаборантом), добавить раствор азотной кислоты объемом 2 мл, раствор серной кислоты объемом 2 мл, раствор сульфосалициловой кислоты объемом 10,00 мл (последнюю отобрать пипеткой). Содержимое колбы довести до метки дистиллированной водой.
3. В другую мерную колбу (Сх+а) объемом 100 мл, содержащую также анализируемый раствор (выдается тоже лаборантом), добавить те же реактивы и в тех же объемах, что и в первую, и стандартный раствор соли железа (III) определенного объема (2 мл). Содержимое второй колбы довести до метки дистиллированной водой (получен анализируемый раствор с добавкой стандартного).
4. Измерение оптической плотности приготовленных растворов
1. Колориметр включить в сеть за 15 минут до начала измерений. Во время прогрева кюветное отделение должно быть открыто (при этом шторка перед фотоприемниками перекрывает световой пучок).
2. Установить минимальную чувствительность колориметра. Для этого ручку ЧУВСТВИТЕЛЬНОСТЬ установить в положение «1», ручку УСТАНОВКА 100 ГРУБО — в крайнее левое положение.
3. Ввести необходимый по роду измерения цветной светофильтр (540 нм).
4. Перед измерениями и при переключении фотоприемников проверить установку стрелки колориметра на «0».
5. В световой пучок поместить кюветы с водой и первым анализируемым раствором.
6. Закрыть крышку кюветного отделения.
7 Ручками ЧУВСТВИТЕЛЬНОСТЬ и УСТАНОВКА 100 ГРУБО и ТОЧНО установить отсчет 100 по шкале колориметра. Ручка ЧУВСТВИТЕЛЬНОСТЬ может находиться в одном из трех положений: «1», «2» или «3».
8. Затем, поворотом ручки (4) кювету с водой заменить кюветой с исследуемым раствором.
9.Снять отсчет по шкале D в единицах оптической плотности.
10.Измерение проводить 3 раза и окончательное значение измеренной величины определить как среднее арифметическое из полученных значений. Данные занести в таблицу.
11.Аналогично определить оптическую плотность анализируемого раствора с добавкой стандартного.
12. По окончании работы вынуть кюветы из кюветодержателей, растворы вылить. Промыть кюветы сначала водопроводной, затем дистиллированной водой и протереть фильтровальной бумагой наружные стенки.
Применяя основной закон светопоглощения, к сравниваемым растворам имеем:
Ах = ε Сх l х ; Ах+а = ε Сх+а l х+а ,
где Ах – оптическая плотность анализируемого раствора;
Ах+а - оптическая плотность анализируемого раствора с добавкой стандартного раствора
ε- молярный коэффициент поглощения;
Сх – концентрация исследуемого раствора;
Сх+а - концентрация раствора с добавкой стандартного;
lх, lх+а - толщина поглощающего слоя.
Решая эти уравнения относительно неизвестной концентрации, получают расчетную формулу:
Сх = Ах Са / (Ах+а - Ах), (2)
Са – концентрация добавки.
1. Рассчитываем концентрацию добавки
Са = (V(добавки) * С (раствора)) / V (колбы) (3)
2. По формуле (2) вычисляем концентрацию анализируемого вещества в г/мл.
3. Полученную концентрацию иона умножаем на объем анализируемого раствора (100 мл), вычисляем общую массу железа.
Вывод:
В выданном растворе определено железо (III) с массой, равной….