Работа 5. Комплексонометричекое титрование
Работа 5. Комплексонометрическое титрование
Оглавление
Теоретическая часть
Комплексометрическое титрование основано на реакциях, при которых определяемые ионы образуют комплексные соединения с некоторыми органическими соединениями. Если при этом получаются внутрикомплексные соединения – хелаты, как, например, с комплексонами, то имеет место хелатометрическое титрование.
Комплексоны – это группа органических соединений – производных аминополикарбоновых кислот, из которых простейшей можно считать иминодиуксусную кислоту.
В практике технического и агрохимического анализа наиболее широко применяют двунатриевую соль этилендиаминтетрауксусной кислоты – комплексон III.
Это соединение называют трилон Б обозначают сокращенной формулой Na2H2Y или ЭДТА.
Комплексон III образует со многими катионами достаточно прочные и растворимые в воде внутрикомплексные соли. Последние получаются в тех случаях, когда катион металла замещает атомы водорода функциональных групп органического соединения и одновременно взаимодействует с другими группами посредством координационной связи.
Образование комплексоном III внутрикомплексного соединения с каким-нибудь двухзарядным катионом происходит путем замещения металлом атомов водорода карбоксильных групп и одновременного взаимодействия катиона с атомами азота аминогрупп (за счет координационной связи):
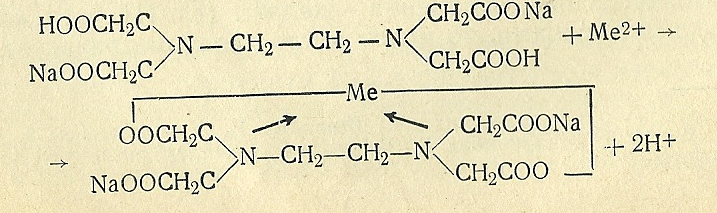
Сплошными линиями показаны обычные связи, а стрелками – координационные. Титрование комплексоном III используют для количественного определения этих катионов. Разумеется, при этом приходится устанавливать точку эквивалентности с помощью индикатора.
Индикаторы хелатометрического титрования
Реакции комплексообразования сопровождаются обычно выделением ионов водорода в количестве эквивалентном катионам. Ионы водорода можно определить алкалиметрически с одним из кислотно-основных индикаторов или индикаторов рН.
Иногда точку эквивалентности хелатометрического титрования определяют физико-химическими методами.
Но чаще всего используют специфические индикаторы-комплексообразователи, т.е. органические красители, образующие с катионами окрашенные компл. соед-я. Например, катионы кальция, магния (и некоторые другие) дают с такими индикаторами внутрикомплексные соединения красного цвета. Эти соединения, однако, менее прочные, чем комплексы тех же катионов с комплексоном III.
Поэтому при титровании анализируемого раствора комплексоном III ионы металла переходят от индикатора к комплексону и выделяется свободный индикатор, имеющий синий окраску. Т.о., в точке эквивалентности красная окраска раствора сменяется синей.
Хромоген черный специальный ЕТ-00
Анион этого красителя, обозначаемый через HInd2-, имеет в щелочной среде синюю окраску. С катионами двухвалентных металлов (магния и других) он образует комплексы винно-красного цвета:
Me2+ + HInd2- = MeInd- + H+
синий винно-
красный
При последующем титровании комплексоном III эти комплексы разрушаются: ионы металла связываются комплексоном в более прочные (менее диссоциирующие) комплексные соединения, а анионы индикатора переходят в раствор, сообщая ему синюю окраску:
MeInd- + [H2Y]2- = [MeY]2- + HInd2- + H+
винно- бесцветн. бесцветн. cиний
красный
В результате этого винно-красная окраска раствора сменяется синей. Наиболее четко она изменяется в щелочной среде, при рН 8-10. Поэтому к титруемому раствору добавляют аммонийную буферную смесь (NН4ОН+NH4С1), которая нейтрализует выделяющиеся при реакции ионы водорода. Переход окраски считают не менее четким, чем в случае кислотно-основных индикаторов.
Обычно 0,5 г хромогена черного растворяют в 10 мл аммонийного буферного раствора и доводят объем жидкости этиловым спиртом до 100 мл. Однако спиртовой раствор индикатора не очень стоек. Поэтому вместо него часто пользуются сухой смесью 1 г хромогена черного со 100 г (или 200 г) индифферентного наполнителя, например химически чистого хлорида натрия. Смесь тщательно растирают в фарфоровой ступке. Перед титрованием вносят в раствор 20—30 мг этой смеси на конце шпателя.
Экспериментальная часть
Определение общей жесткости воды
В практике хелатометрическое титрование применяют для определения общей жесткости природных вод, которую принято характеризовать суммарным числом тысячных долей эквивалентных масс кальция и магния в 1 л воды.
Анализируемую воду подщелачивают аммонийной буферной смесью до рН ≈ 10. Индикатором служит обычно хромоген черный специальный ЕТ-00, образующий с ионами Са2+ и Mg2+ растворимые комплексы винно-красного цвета:
Са2+ + HInd2- = CaInd- + Н+; Mg2+ + HInd2- = MgInd- + H+
винно-красный вино-красный
Константы устойчивости этих комплексов равны соответственно 2,6 ∙ 106 и 1∙107. Но константы устойчивости комплексов Са2+ и Mg2+ с комплексоном III гораздо больше (3,7 ∙ 107 и 5 ∙108). Поэтому при титровании комплексы металлов с индикатором разрушаются и образуются более прочные комплексы с комплексоном III:
CaInd- + Na2[H2Y] = Na2[CaY] + HInd2- + H+
винно-красный синий
MgInd- + Na2[H2Y] = Na2[MgY] + HInd2- + H+
винно-красный синий
В эквивалентной точке винно-красная окраска раствора сменяется синей вследствие накопления анионов индикатора.
Необходимую для определения аммонийную буферную смесь приготовляют в мерной колбе вместимостью 1000 мл, смешивая 100 мл раствора хлорида аммония с массовой долей NH4C1 20% со 100 мл раствора аммиака с массовой долей NH3 20% и доводя объем смеси водой до метки.
Обычно природную воду титруют 0,05 н. раствором комплексона III. Раствор приготовляют из точной навески химически чистого препарата, учитывая, что формула комплексона III Na2C10H14O8N2 ∙ 2Н2O, а молярная масса эквивалента его в данной реакции равна половине молярной массы (Z = 2). Иногда нормальную концентрацию раствора комплексона устанавливают по 0,05 н. раствору сульфата магния MgS04 ∙ 7H20, приготовленному из фиксанала (или по хлориду кальция).
Цель работы:
1. Ознакомление с методом комплексонометрического титрования.
2. Освоение методики приготовления растворов трилона Б и аммонийной буферной смеси.
3. Приобретение навыков расчетов результатов общей жесткости воды.
Задача: Определить общую жесткость водопроводной воды.
Приборы и реактивы:
1) Штатив, бюретка для титрования, конические колбы для титрования, пипетка вместимостью 100 мл, цилиндр мерный вместимостью 10 мл
2) Аммонийная буферная смесь, 0,05н раствор комплексона III, исследуемая вода, индикатор (хромоген черный)
Ход определения
В колбу для титрования отмерьте пипеткой 100,0 мл исследуемой воды и прилейте 5 мл аммонийной буферной смеси. Прибавляйте по каплям раствор индикатора (хромогена черного) до появления хорошо заметной, но не очень темной винно-красной окраски (вместо этого можно внести на конце шпателя 20—30 мг сухой смеси индикатора с хлоридом натрия).
Титруйте воду 0,05 н. раствором комплексона III до перехода винно-красной окраски в синюю. В конце титрования раствор комплексона прибавляйте по одной капле, добейтесь, чтобы красноватый оттенок совершенно исчез. Повторите титрование 2—3 раза и из сходящихся отсчетов возьмите среднее.
Общую жесткость воды (Са2+ и Mg2+ на 1 л) вычисляют по формуле в ммоль/л:
Ж = (Сн * V1) * 1000 / V
где cн — нормальная концентрация раствора комплексона III;
V1 — объем рабочего раствора комплексона, затраченный на титрование;
V — объем воды, взятый для определения.