Лабораторная работа № 3. Анализ катионов четвертой и пятой аналитических групп
Анализ катионов четвертой и пятой аналитических групп
Оглавление
- 1. Общая характеристика катионов IV аналитической группы
- 2. Реакции обнаружения катионов IV аналитической группы
- 2.1 Реакции Al3+ - ионов
- 2.2 Реакции Cr3+ - ионов
- 2.3 Реакции Zn2+ - ионов
- 3. Общая характеристика катионов V аналитической группы
- 4. Реакции обнаружения катионов V аналитической группы
- 4.1 Реакции Fe2+ - ионов
- 4.2 Реакции Fe3+ - ионов
- 4.3 Реакции Mg2+ - ионов
- 4.4 Реакции Mn2+ - ионов
1. Общая характеристика катионов IV аналитической группы
В IV аналитическую группу входят Al3+, Cr3+, Zn2+, As(III), As(V), Sn(II), Sn(IV). Эти катионы образуют амфотерные гидроксиды или растворимые соли кислородсодержащих кислот и поэтому хорошо растворяются в избытке щелочей. Групповым реагентом на катионы четвертой группы является NaOH в избытке.
При действии на катионы IV аналитической группы стехиометрического количества KOH или NaOH образуются труднорастворимые аморфные, окрашенные в различные цвета осадки соответствующих гидроксидов: белые –Al(OH)3, Zn(OH)2, зеленый – Cr(OH)3.
Осадки гидроксидов растворимы в разбавленных кислотах. В избытке щелочи все осадки этих амфотерных гидроксидов растворяются с образованием зеленого хромита и бесцветных алюминатов, цинкатов, станнитов:
Cr(OH)3 + OH- → CrO2- + 2 H2O,
Al(OH)3 + OH- → AlO2- + 2 H2O,
Zn(OH)2 + OH- → ZnO2- + 2 H2O,
Sn(OH)2 + OH- → SnO2- + 2 H2O.
Из растворов полученных солей можно снова выделить осадки гидроксидов при осторожном действии растворами кислот
AlO2- + Н+ → Al(OH)3,
ZnO2- + 2Н+ → Zn(OH)2.
Но более полное выделение в осадок гидроксидов катионов четвертой группы, кроме Zn(OH)2, возможно при действии на растворимые соли соответствующих слабых кислот солями аммония при нагревании (нагревание способствует, как известно, полноте осаждения)
CrO2- + NH4+ + 2H2O = Cr(OH)3↓ + NH4OH,
SnO2- + 2NH4+ + 2H2O = Sn(OH)3↓ + 2NH4OH,
AlO2- + NH4+ + 2H2O = Al(OH)3↓ + NH4OH.
Zn(OH)2 подобным образом получить невозможно, так как этот гидроксид в избытке NH4+ переходит в растворимый комплексный аммиакат цинка
ZnO22- + 4NH4+ → [Zn(NH3)4]2+ + 2H2O
Образование растворимого аммиаката цинка отличает цинк от всех остальных катионов четвертой группы и способствует их разделению.
Гидроксид хрома обладающий восстановительными свойствами, в присутствии окислителей, например, пероксида водорода, легко окисляется:
2Cr(OH)3 + 3H2O2 + 4OH- → 2CrO42- + 8H2O
2. Реакции обнаружения катионов IV аналитической группы
Цель работы: Изучение реакций обнаружения катионов IV аналитической группы.
В ходе работы студенты получают практические навыки выполнения аналитических реакций, характерных для катионов IV аналитической группы, осуществления контроля за кислотностью реакционной среды и температурными условиями протекания реакций, правильного и безопасного использования центрифуги для отделения осадков, проведения микро-кристаллоскопического анализа.
Полученные знания и умения необходимы при проведении анализа образца неизвестного состава, в частности, при выполнении контрольной работы № 1.
2.1 Реакции Al3+ - ионов
Водные растворы солей алюминия бесцветны.
1. Реакция образования гидроксида алюминия.
Полное осаждение Al(OH)3 достигается при рН = 5. При действии избытка щелочи (рН > 10) на раствор, содержащий ион Al3+, образуется растворимый гидроксокомплекс алюминия по реакции:
Al3+ + 4OH- → [Al(OH)4]-
Добавление к полученному раствору хлорида аммония приводит к связыванию избыточных гидроксильных ионов в малодиссоциированные молекулы NH4OH, которые с избытком хлорида аммония представляют аммонийную буферную смесь (рН = 9). При этом значении рН реакция останавливается на стадии образования белого осадка Al(OH)3, который устойчив в интервале рН = 5–10:
[Al(OH)4]- + NH4+ → Al(OH)3↓ + NH4OH
Выполнение реакции:
К 4-5 каплям раствора соли алюминия осторожно по каплям при перемешивании добавляют 2 М раствор NaOH (или KOH) до полного растворения образующегося белого осадка гидроксида алюминия. К полученному раствору по каплям прибавляют насыщенный раствор NH4Cl до рН = 9 (контроль по универсальной индикаторной бумаге) и нагревают на водяной бане. Наблюдают образование аморфного осадка гидроксида алюминия в виде белых студенистых хлопьев.
2. Люминесцентная реакция с 2,3-оксинафтойной кислотой.
Реакция основана на люминисцентном свечении комплекса алюминия с 2,3-оксинафтойной кислотой, образующегося по реакции:
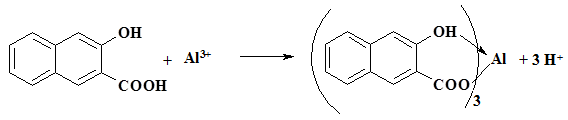
Выполнение реакции:
На полоску фильтровальной бумаги, пропитанную 2,3-оксинафтойной кислотой и гексаметилентетрамином (получить у лаборанта), наносят каплю раствора соли алюминия и помещают под ультрафиолетовое излучение (ƛ= 254 нм). Наблюдают голубое свечение пятна комплекса на зеленом фоне.
Аналогичное свечение дает борная кислота и ее соли. Мешающее действие оказывают ионы Fe3+ и Cr3+, гасящие люминесценцию.
3. Реакция с 8-Гидроксихинолином
8 –Гидроксихинолин 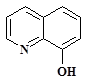 при pH = 5 образует с ионом Al3+ малорастворимое соединение зеленовато-желтого цвета, флуоресцирующее зеленоватым светом при УФ-облучении.
при pH = 5 образует с ионом Al3+ малорастворимое соединение зеленовато-желтого цвета, флуоресцирующее зеленоватым светом при УФ-облучении.
Выполнение реакции:
На кусочек фильтровальной бумаги поместите 1 каплю раствора AlCl3, 1 каплю ацетатного буферного раствора с рH 4,5-6,0 и 1 каплю этанольного раствора реагента. Влажное пятно рассмотрите в УФ-свете (прибор!) и убедитесь в появлении зеленоватого свечения.
4. Ализарин (1,2-Диоксиантрахинон) дает с гидроокисью алюминия малорастворимое соединение ярко-красного цвета, называемое «алюминиевым лаком».
Формула ализарина:
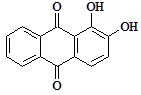
По-видимому, состав образующегося соединения отвечает формуле:
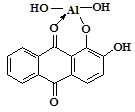
Подобные окрашенные лаки дают с ализарином и другие катионы. Поэтому необходимо отделять их от А13+. При выполнении реакции капельным методом это достигается применением подстилки из K4[Fe(CN)6], с которым мешающие реакции катионы дают малорастворимые гексацианоферраты(II) и остаются, таким образом, в центре пятна. Ионы же А13+, не осаждаемые K4[Fe(CN)6], диффундируют на периферию пятна, где и могут быть обнаружены действием ализарина в присутствии NH4OH.
Выполнение реакции:
На полоску фильтровальной бумаги наносят каплю раствора K4[Fe(CN)6]. В центр влажного пятна помещают каплю исследуемого раствора. Для этого прикасаются к бумаге кончиком капилляра, в котором капиллярными силами удерживается немного исследуемого раствора, и держат капилляр так несколько секунд. Если в растворе кроме А13+ присутствуют мешающие реакции катионы (например, Fe3+), то в центре пятна появляется осадок малорастворимых гексацианоферратов(II). Чтобы вымыть из него адсорбированные А13+-ионы, полезно таким, же путем нанести на осадок каплю воды.
Обрабатывают пятно газообразным аммиаком, для чего помещают бумагу над отверстием склянки с концентрированным раствором аммиака.
Пятно по периферии обводят капилляром с раствором ализарина и снова обрабатывают газообразным аммиаком. При этом не должно оставаться желтого окрашивания, свойственного ализарину в кислой среде.
В присутствии А13+ появляется розовое кольцо на фиолетовом фоне. Этот фон представляет собой окраску ализарина, принимаемую им в щелочной среде. Поскольку фон несколько затрудняет наблюдение розовой окраски, вызываемой А13+, бумагу осторожно высушивают, держа высоко над пламенем горелки. При этом аммиак улетучивается, и фиолетовая окраска ализарина переходит в желтую, не мешающую наблюдению окраски алюминиевого лака. Реакция применяется для дробного открытия А13+ в присутствии других катионов.
Эту реакцию можно проводить и в пробирке в слабоуксуснокислой среде. Для лучшей коагуляции розового осадка раствор следует нагреть.
2.2 Реакции Cr3+ - ионов
Хром образует два ряда устойчивых солей: соли хрома(III) и соли хрома(VI).
Растворы солей окиси хрома содержат хром в виде трехзарядного катиона Сг3+.
При действии различных окислителей хром (III) переходит в CrVI, образуя анионы хромовой кислоты Сг042- (хромат-ион) или двухромовой кислоты Сг2О72- (бихромат-ион).
Растворы солей хрома (III) имеют зеленую или фиолетовую окраску, растворы хроматов - желтую, растворы бихроматов -оранжевую окраску.
1. Едкие щелочи NaOH и КОН дают с Сг3+ осадок Сг(ОН)3 серо- фиолетового или серо-зеленого цвета, обладающий амфотерными свойствами. Уравнения реакций аналогичны уравнениям соответствующих реакций А13+.
Образующиеся при действии щелочей на Сr(ОН)3 хромиты NaCr02 и КСг02 окрашены в ярко-зеленый цвет.
В отличие от алюминатов они необратимо разлагаются при кипячении (гидролиз) с образованием Сr(ОН)3:
NaCr02 + 2H20 → Cr(OH)3↓ + NaOH
2. Аммиак NH4OH и соли слабых кислот [Nа2СО3, (NH4)2S и др.] также осаждают Сr3+ в виде Сr(ОН)3.
Поскольку полное осаждение Сr(ОН)3 достигается при рН = 6, оно происходит также и при действии амонийной буферной смеси (NH4OH + NH4C1), создающей рН = 8-10 (ср. с реакциями А13+).
3. Ацетат натрия CH3COONa (при нагревании) не осаждает Сг3+ (отличие от А13+ и Fe3+) вследствие образования комплексного катиона. Однако в присутствии катионов А13+ и Fe3+ частично осаждается также и Сr3+.
4. Гидрофосфат натрия Na2HP04 дает с Сr3+ зеленоватый осадок CrPO4. Реакция идет также, как с А13+. Осадок растворим в минеральных кислотах и щелочах.
5. Окисление хрома (III) до хрома (VI) может быть осуществлено действием различных окислителей, например Н202, Na202, С12, и Br2, KMn04, (NH4)2S2O8 и т. п. В щелочной среде образуются СrO42- -ионы. Окисление в кислой среде приводит к образованию Сr2072--ионов.
Учитывая сказанное, рассмотрим оба случая окисления отдельно.
a) Окисление в щелочной среде (реакция образования хромат - иона).
Обнаружение ионов Cr3+ по этой реакции основано на его окислении пероксидом водорода в щелочной среде до хромат-иона, имеющего желтую окраску:
2Cr3+ + 3H2O2 + 10OH- → CrO42- + 8H2O
Выполнение реакции:
2-3 капли раствора соли хрома (III) помещают в коническую пробирку, добавляют 4-5 капель 2 М раствора NaOH, 4-5 капель 3 % раствора H2O2 и нагревают на водяной бане. Наблюдают желтую окраску реакционной смеси.
Для подтверждения образования хромат-иона к полученному раствору добавляют несколько капель 6 М раствора уксусной кислоты до рН = 5 (контроль по универсальной индикаторной бумаге), после чего добавляют 2-3 капли раствора соли бария. Наблюдают образование желтого осадка хромата бария, который отделяют от раствора на центрифуге:
CrO42- + Ba2+ → BaCrO4↓
б) Окисление в кислой среде (реакция образования бихромат - иона).
Окисление в кислой среде может быть осуществлено действием KMnO4, (NH4)2S2O8 и некоторых других наиболее сильных окислителей.
Рассмотрим действие персульфата аммония (NH4)2S2O8 на Cr2(SO4)3.
Реакция протекает по уравнению:
2Cr3+ + 3S2O82- + 7H2O → Cr2O72- + 6SO42- + 14H+
Выполнение реакции:
В пробирку берут 5-6 капель раствора (NH4)2S2O8, прибавляют к нему по 1 капле 2н. растворов Н2SO4 и соли серебра (катализатор), в полученную окислительную смесь вводят 2-3 капли раствора Cr2(SO4)3 или Cr(NO3)3 (не CrCl3!) и нагревают. При этом происходит изменение окраски.
Аналогично персульфату действует на Cr3+ перманганат калия:
2Cr3+ + 2MnO4- + 5H2O → 2MnO(OH)2 + Cr2O72- + 6H+
Реакция сопровождается образованием бурого осадка марганцовистой кислоты МnО(ОН)2 и идет при нагревании.
6. Образование надхромовой кислоты.
Обнаружение ионов Cr3+ по этой реакции основано на его последовательном окислении до дихромат-иона и надхромовой кислоты действием избытка перманганата калия и пероксида водорода в кислой среде:
2Cr3+ + 2MnO4- + 5H2O → Cr2O72- + 2MnO(OH)2↓ + 6H+
Cr2O72- + 4H2O2 + 2H+ → 2H2CrO6 + 3H2O
Образование бурого осадка диоксида марганца MnO(OH)2 обусловлено окислением первоначально образующихся в кислой среде ионов Mn2+ избытком перманганата калия:
3Mn2+ + 2MnO4- + 7H2O → 5MnO(OH)2↓ + 2H+
Образующаяся надхромовая кислота H2CrO6 окрашивает раствор в синий цвет. Однако, в водных растворах надхромовая кислота неустойчива и быстро разлагается до соединений хрома(III) зеленого цвета. Поэтому ее экстрагируют из водного раствора каким-либо органическим экстрагентом, слой которого окрашивается в интенсивно синий цвет.
Выполнение реакции:
2-3 капли раствора соли хрома(III) помещают в коническую пробирку, добавляют 4-5 капель 6 М азотной кислоты, 5-6 капель раствора KMnO4 и нагревают на водяной бане в течение 1-2 минут. Фиолетовая окраска раствора указывает на то, что взятого количества перманганата хватило для окисления всех имеющихся в растворе ионов Cr3+ до Cr2O72-. В противном случае следует добавить еще 1-2 капли раствора перманганата и повторить операцию. Добившись фиолетовой окраски, осадок образовавшегося диоксида марганца центрифугируют, а центрифугат сливают в чистую пробирку и охлаждают под водопроводной водой. Затем прибавляют к нему 8-10 капель изоамилового спирта, 5-6 капель раствора пероксида водорода и полученную реакционную смесь энергично встряхивают. При этом избыток перманганата восстанавливается до Mn2+, a Сг2072--ионы образуют надхромовую кислоту, которая при взбалтывании переходит в слой амилового спирта, окрашивая его в синий цвет, что подтверждает наличие в исследуемом растворе хрома.
7. Образование малорастворимых солей (реакции Сr042- - иона).
Ион Сr042- дает малорастворимые соли с Pb2+, Ag+ и Ва2+, что может быть использовано для его обнаружения и отделения. Реакции идут по уравнениям:
Сr042- + Рb2+ → PbCrO4↓
желтого цвета
Сr042- + Ba2+ → BaCrO4↓
желтого цвета
Сr042- + 2Ag2+ → Ag2CrO4↓
кирпично-красного цвета
Реакцию следует выполнять в присутствии ацетатной буферной смеси.
2.3 Реакции Zn2+ - ионов
Водные растворы солей цинка бесцветны.
1. Реакция с дитизоном.
Дитизон (дифенилтиокарбазон) в щелочной среде (рН > 10) образует с ионами Zn2+ внутрикомплексное соединение, окрашенное в малиново-красный цвет:
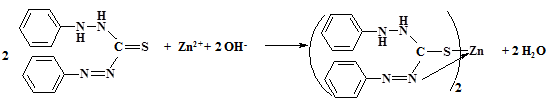
Выполнение реакции:
5 капель раствора соли цинка помещают в пробирку и по каплям добавляют 6 М раствор NaOH до растворения образующегося белого осадка гидроксида цинка (образуется гидроксокомплекс [Zn(OH)4]2-). Помещают 1 каплю полученного раствора на полоску фильтровальной бумаги и по периферии влажного пятна наносят раствор дитизона в четыреххлористом углероде. Наблюдают малиново-красное окрашивание.
В отсутствии ионов цинка имеет место оранжевое окрашивание, свойственное свободному дитизону в щелочной среде. Для наглядности следует проделать «холостой опыт», для чего наносят на бумагу 1 каплю 6 М раствора NaOH и раствор дитизона по периферии пятна. Наблюдают оранжевое окрашивание.
2. Реакция с сульфидом натрия.
При действии на сильнощелочной раствор соли цинка (pH > 10) раствора сульфида натрия Na2S образуется белый осадок сульфида цинка:
[Zn(OH)4]2- + S2- → ZnS↓ + 4 OH-
Выполнение реакции:
2-3 капли раствора гидроксокомплекса цинка, полученного при изучении реакции ионов цинка с дитизоном (см. п. 1), помещают в чистую пробирку, добавляют 1-2 капли раствора Na2S и наблюдают образование белого осадка.
3. Микрокристаллоскопическая реакция с тетрароданомеркуриатом аммония.
Тетрароданомеркуриат аммония (NH4)2[Hg(SCN)4] с ионами цинка образует белый кристаллический осадок в форме крестов и дендритов:
Zn2+ + [Hg(SCN)4]2- → Zn[Hg(SCN)4]↓
Выполнение реакции:
На предметное стекло помещают 1 каплю раствора соли цинка, 1 каплю 2 М раствора уксусной кислоты и 1 каплю раствора тетрароданомеркуриата аммония. Осторожно смешивают капли стеклянной палочкой и через 1-2 минуты рассматривают под микроскопом форму образовавшихся кристаллов.
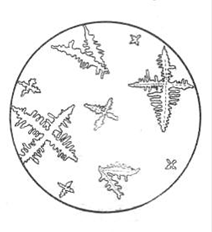
Рис. Кристаллы тетрароданомеркуриата цинка Zn[Hg(SCN)4]
Обнаружению ионов цинка по этой реакции мешает присутствие ионов Со2+, дающих нехарактерные кристаллы Сo[Hg(SCN)4] синего цвета.
4. Едкие щелочи NaOH и КОН дают с Zn2+ белый осадок Zn(OH)2 (или H2Zn02), растворимый и в кислотах и в щелочах (амфотерность), например:
Zn(OH)2↓+ 2Н+ → Zn2+ + 2Н20
H2Zn02↓+ 2ОН- → ZnO22- + 2Н20
Цинкат-ион ZnO22- в отличие от алюминатов при действии NH4C1 не образует осадка Zn(OH)2, так как он растворим в солях аммония (см. ниже).
5. Аммиак NH4OH образует осадок Zn(OH)2, который растворяется в избытке NH4OH вследствие образования [Zn(NH3)6]2+ или [Zn(NH3)4]2+, например:
Zn(OH)2↓+ 6NH4OH → [Zn(NH3)6]2+ + 20Н- + 6Н20
Гидроксид цинка, обладая сравнительно большой величиной произведения растворимости (ПР Zn(OH)2= 7,1 * 10-18), растворяется также в хлориде аммония.
Поэтому Zn2+ в присутствии соли аммония не осаждается в виде гидроокиси.
6. Гидрофосфат натрия Na2HP04 дает белый осадок Zn3(P04)2, растворимый в кислотах, щелочах и аммиаке. В присутствии солей аммония в осадок выпадает менее растворимая двойная соль ZnNH4PO4.
7. Гексацианоферрат(II) калия K4[Fe(CN)6] образует с Zn2+ белый осадок двойной соли — гексацианоферрата(II) цинка и калия, растворимый в щелочах:
3Zn2+ + 2К+ + 2[Fe(CN)6]4- → K2Zn3[Fe(CN)6]2↓
Эта реакция отличает Zn2+ от А13+, который с K4[Fe(CN)6] осадка не образует.
8. Гексацианоферрат(III) калия K3[Fe(CN)6] образует с Zn2+ коричневато-желтый осадок Zn3[Fe (СN)6]2, растворимый в НС1 и NH4OH.
3. Общая характеристика катионов V аналитической группы
Катионы этой группы при действии на них NH4OH, а также NaOH или КОН образуют осадки гидроксидов, легко растворимых в минеральных кислотах.
|
Гидроксид |
Цвет осадка |
рН начала осаждения |
IIP |
Растворимость, моль/л |
|
Fe(OH)2 |
Белый |
7,4-8,8 |
6,3*10-16 |
4,9*10-6 |
|
Fe(OH)3 |
Красно- бурый |
2,2-3,2 |
3,8* 10-38 |
1,9*10-9 |
|
Mg(OH)2 |
Белый |
9,4-10,9 |
5*10-12 |
1,1*10-4 |
|
Mn(OH)2 |
Белый |
7,9-9,4 |
4*10-14 |
2,1*10-5 |
|
Bi(OH)3 |
Белый |
4,4-5,5 |
- |
- |
|
Sb(OH)3 |
Белый |
0,9-1,9 |
4*10-42 |
1,9*10-11 |
Гидроксиды не растворимы ни в избытке аммиака, ни в избытке щелочей, за исключением Sb(OH)3, который в избытке щелочи образует антимонит
Sb(OH)3+NaOH = NaSbO2 +2Н20 .
Белый осадок Fe(OH)2 на воздухе быстро окисляется и переходит в зеленый и затем в красно-бурый Fe(OH)3. Белый осадок Мn(ОН)2 также неустойчив и на воздухе быстро переходит в коричневый осадок МnО(ОН)2 или Н2Мn03.
4. Реакции обнаружения катионов V аналитической группы
Цель работы: Изучение реакций обнаружения катионов V аналитической группы.
В ходе работы студенты получают практические навыки выполнения аналитических реакций, характерных для катионов V аналитической группы, осуществления контроля за кислотностью реакционной среды и температурными условиями протекания реакций, правильного и безопасного использования центрифуги для отделения осадков, проведения микро- кристаллоскопического анализа.
Полученные знания и умения необходимы при проведении анализа образца неизвестного состава, в частности, при выполнении контрольной работы № 1.
4.1 Реакции Fe2+-ионов
Водные растворы солей железа(II) окрашены в бледно-зеленый цвет.
1. Реакция с гексацианоферратом(III) калия.
Гексацианоферрат(III) калия (феррицианид калия) K3[Fe(CN)6] образует с ионами Fe2+ синий осадок «турнбулевой сини»:
3Fe2+ + 2[Fe(CN)6]3- → Fe3[Fe(CN)6]2↓
Реакция проводится в слабокислых или нейтральных растворах (рН = 3–7), строго специфична и позволяет дробно обнаруживать ион Fe2+ в присутствии других катионов.
Выполнение реакции:
ВНИМАНИЕ!!! Растворы солей железа(II) легко окисляются на воздухе, поэтому раствор для испытаний готовят непосредственно перед опытом, растворяя несколько кристаллов сухого FeSO4 в небольшом количестве воды.
В пробирку помещают 2-3 капли раствора соли железа(II), добавляют 1 каплю 2 М раствора HCl и 1-2 капли раствора K3[Fe(CN)6]. Наблюдают образование темно-синего осадка.
2. Реакции с едкими щелочами, гидроксидом аммония (на примере NaOH).
Едкие щелочи NaOH и КОН осаждают Fe2+ в виде Fe(OH)2:
|
FeCl2 + 2NaOH = Fe(OH)2↓ + 2NaCl (ПР Fe(OH)2 = 7,1 . 10-16) |
|
Образуется аморфный осадок гидроксида железа (II) грязно-зелёного цвета. Осадок растворим в кислотах, но не растворим в избытке щёлочи. На воздухе осадок постепенно окисляется до гидроксида железа (III) красно-бурого цвета.
Аммиак также осаждает Fe(OH)2, но осаждение это не полное. В присутствии солей аммония Fe(OH)2 совсем не осаждается. Причина этого заключается в сравнительно большой величине произведения растворимости Fe(OH)2, которое не достигается при концентрации ОН-, создаваемой аммонийной буферной смесью.
3. Реакция с диметилглиоксимом (реактив Чугаева) C4H8O2N2 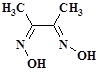 .
.
Диметилглиоксим с Fe2+ дает растворимые в воде внутрикомплексные соли красного цвета [Fe(C4H7O2N2)2]. Реакцию ведут в аммиачной среде в присутствии винной кислоты, прибавляемой для связывания в комплекс Fe3+-ионов, которые дали бы с аммиаком осадок Fe(OH)3.
Так как диметилглиоксим является важнейшим реагентом на Ni2+, с которым он образует осадок розового цвета, присутствие Fe2+ мешает обнаружению Ni2+. Применять рассматриваемую реакцию для обнаружения Fe2+ можно только при доказанном отсутствии Ni2+ (или после связывания его действием KCN в прочный комплекс [Ni(CN)4]2-).
|
FeCl2 + 2C4H8O2N2 = [Fe(C4H7O2N2)2] + 2HCl |
|
4. Реакция с сероводородом H2S.
|
FeCl2 + H2S = FeS↓ + 2HCl (ПРFeS = 5. 10-18) |
|
Образуется осадок сульфида железа FeS чёрного цвета. Осадок растворяется в разбавленной HCl с выделением H2S.
5. Окисление Fe2+ до Fe3+.
Ион Fe2+ представляет собой довольно сильный восстановитель и способен окисляться при действии ряда окислителей, например Н2О2, КМnO4, K2Cr2O7 в кислой среде, HNO3 и др. Остановимся подробнее на окислении азотной кислотой.
Реакция идет по уравнению:
|
3Fe2+ + 4Н+ + NO3- → 3Fe3+ + 2H2O + NO↑ Выполнение реакции: Для выполнения реакции берут 2-3 капли раствора соли железа (II), прибавляют 2 капли 2н. раствора H2SO4 и 1-2 капли 6н. раствора HNO3. Нагревают до исчезновения бурой окраски, зависящей от образования нестойкого комплексного соединения [Fe(NO)]SO4, которое при нагревании разлагается. |
|
Окисление Fe2+ в щелочной среде может быть осуществлено, например, действием Н2О2:
|
2FeCl2 + H2O2 +4NaOH = 2Fe(OH)3↓ + 4NaCl |
|
Образуется осадок гидроксида железа (III) красно- бурого цвета.
4.2 Реакции Fe3+-ионов
Водные растворы солей железа(III) имеют желтую окраску.
1. Реакция с гексацианоферратом(II) калия.
Гексацианоферрат(II) калия (ферроцианид калия) K4[Fe(CN)6] образует с ионами Fe3+ темно-синий осадок «берлинской лазури»:
4Fe3+ + 3[Fe(CN)6]4- → Fe4[Fe(CN)6]3↓
Реакция проводится в слабокислых или нейтральных растворах (рН = 3–7), строго специфична и позволяет дробно обнаруживать ион Fe3+ в присутствии других катионов.
Выполнение реакции:
В пробирку помещают 2-3 капли раствора соли железа(III), добавляют 1 каплю 2 М раствора HCl и 1-2 капли раствора K4[Fe(CN)6]. Наблюдают образование темно-синего осадка.
2. Реакция с тиоцианат-ионами.
Тиоцианат-ионы SCN- образуют с ионами Fe3+ комплексные соединения, окрашивающие раствор в красный цвет. В зависимости от соотношения концентраций реагентов могут образовываться комплексы различного состава [Fe(SCN)n(H2O)6-n]3-n, где n = 1, 2 . . . 6. При избытке реагента образуется координационнонасыщенный комплекс:
Fe3+ + 6SCN- → [Fe(SCN)6]3-
Выполнение реакции:
К 2-3 каплям раствора соли железа(III) добавляют 1-2 капли раствора тиоцианата (роданида) аммония NH4SCN или калия KSCN. Наблюдают красное окрашивание реакционной смеси.
Далее к полученному окрашенному раствору добавляют несколько капель раствора фторида аммония (или натрия). Наблюдают исчезновение красной окраски (обесцвечивание) вследствие образования более прочного бесцветного фторидного комплекса железа(III):
[Fe(SCN)6]3- + 6F- → [FeF6]3- + 6SCN-
3. Реакции со щелочью и аммиаком.
Едкие щелочи NaOH и КОН и аммиак NH4OH дают с Fe3+ красно бурый осадок Fe(OH)3. В отличие от Al(OH)3 и Cr(OH)3 гидроокись железа практически не обладает амфотерными свойствами и потому нерастворима в избытке щелочи (испытайте!). Так как полное осаждение Fe(OH)3 достигается при рН=3,5, она осаждается также при действии аммиака и смесей его с аммонийными солями.
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl (ПРFe(OH)3 = 6,3 . 10-40)
Осадок растворим в кислотах.
4. Реакция окисления-восстановления.
|
Поскольку Fe3+ способен восстанавливаться до Fe2+, он является окислителем. Ион Fe3+ окисляет ионы I- до I2: 2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl |
|
Раствор окрашивается в жёлтый цвет вследствие выделения иода, образующего с избытком реактива окрашенный растворимый комплекс – KI3. Если в ту же пробирку прибавить несколько капель бензола С6Н6 (или хлороформа), в которых I2 более растворим, чем в воде, и взболтать, большая часть I2 перейдет в слой органического растворителя, окрашивая его в характерный для иода фиолетовый цвет (экстракция в органический растворитель).
4.3 Реакции Mg2+-ионов
1. Едкие щелочи образуют с Mg2+ белый аморфный осадок Mg(ОН)2:
MgCl2 + 2NaOH = Mg(OH)2↓ + 2NaCl (ПРMg(OH)2 = 6,0 . 10-10)
Гидроокись магния растворима в кислотах и солях аммония (убедитесь в этом на опыте), следовательно, в присутствии NH4+ отделение Mg2+ не может быть полным. Иногда при наличии в растворе NH4+ осадок Mg(ОН)2 может совсем не выпасть.
Следующие опыты подтверждают это:
а) к 2 каплям раствора соли магния прибавляют 2 капли насыщенного раствора NH4Cl и действуют 2 каплями 2 н. раствора аммиака; затем проверяют, выпадает ли осадок;
б) повторяют тот же опыт, но вместо раствора NH4Cl прибавляют 2 капли воды (чтобы сделать одинаковыми концентрации ионов магния и аммиака в обоих опытах).
2. Реакция с гидрофосфатом натрия.
Гидрофосфат натрия Na2HPO4 образует с солями магния в присутствии аммонийной буферной смеси (рН = 9) белый кристаллический осадок двойного фосфата магния и аммония:
Mg2+ + HPO42- + NH4OH → MgNH4PO4↓ + H2O
Присутствие аммонийной буферной смеси необходимо для предотвращения образования осадка Mg(OH)2 и Mg3(PO4)2.
Выполнение реакции:
В пробирку вносят по 1-2 капле растворов соли магния, хлорида и гидроксида аммония, а затем к полученной смеси добавляют 2-3 капли раствора гидрофосфата натрия и наблюдают образование характерного белого кристаллического осадка.
Реакции мешают катионы III аналитической группы, образующие в этих условиях белые осадки фосфатов.
3. Микрокристаллоскопическая реакция.
Обнаружение Mg2+ микрокристаллоскопическим методом проводят, используя реакцию c гидрофосфатом натрия:
Mg2+ + HPO42- + NH4OH → MgNH4PO4↓ + H2O
Выполнение реакции:
Для этого на предметное стекло помещают 1 каплю раствора с осадком, полученного в п. 1, и рассматривают форму кристаллов (звездочки или дендриты, рис.) под микроскопом.
Реакцию можно проводить непосредственно на предметном стекле, когда к капле раствора соли магния в аммонийном буфере добавляют 1 каплю раствора гидрофосфата натрия.


Рис. Кристаллы магнийаммонийфосфата MgNH4PO4
4. Реакция с оксихинолином C9H7ON:
|
Оксихинолин образует с аммиачными растворами солей магния зеленовато- желтый кристаллический осадок оксихинолината магния, представляющий собой малорастворимое внутрикомплексное соединение: MgCl2+ 2C9H7ON = Mg(C9H6ON)2↓ +2HCl |
|
|
|
|
Выполнение реакции:
Для выполнения реакции к капле раствора соли магния прибавляют по капле растворов NH4Cl и NaOH и действуют каплей 5%-ного спиртового или аммиачного раствора реагента.
Реакцию следует выполнять при нагревании во избежание выпадения в осадок самого оксихинолина (это часто имеет место при добавлении спиртового раствора оксихинолина к водному раствору соли магния).
4.4 Реакции Mn2+-ионов
Реакции основаны па окислительно-восстановительных свойствах марганца. Наиболее устойчивыми ионами марганца являются Мn2+и Мn04-. Все соединения промежуточных степеней окисления легко переходят в более устойчивое состояние.
Водные растворы солей марганца(II) бесцветны.
1. Реакция с пероксидом водорода.
При действии на Мn2+ в щелочной среде пероксидом водорода при нагревании образуется коричневый осадок Н2Мn03 (или Мn02)
Mn2+ + 40Н-- 2е-→ Мn02 + 2Н20
H2O2 +2Н+ +2е-→2Н20 _______________
2Мn2+ + Н202 + 20Н- → МnО2+ 2Н20
2. Реакция с персульфатом аммония.
Бесцветные ионы Мn2+ могут быть окислены до розово-фиолетовых перманганат-ионов Мn04- при помощи окислителей: персульфата, висмутата, диоксида свинца и др.
Мп2+ +4Н20 - 5е- → Мп04- + 8Н+
S2O82- + 2е- → 2S042-______________________
2Mn2++5S2082-+8Н20= 2МnО4- + 16Н+ + lOSO42-
Выполнение реакции:
Помещают в пробирку немного персульфата аммония, прибавляют 1 каплю 2 н. раствора азотной или серной кислоты, 2 капли 2 н. раствора нитрата серебра (для каталитического ускорения реакции) и нагревают на водяной бане. В нагретую окислительную смесь вносят на палочке следы разбавленного исследуемого раствора и перемешивают. При нагревании появляется розово-фиолетовое окрашивание. Реакция специфична для марганца. Проведению реакции мешают ионы-восстановители, в том числе ионы С1-. Поэтому реакцию нельзя проводить в солянокислой среде. Для связывания ионов хлора приливают избыток AgNO3.
Перманганат- ионы являются сильными окислителями.
Окислительно-восстановительный потенциал Мn04- сильно зависит от рН среды. Поэтому в кислой среде ионы Мn04- восстанавливаются до Мn2+, в нейтральной — до Мn4+, а в щелочной — до Мn6+.
3. Реакция с висмутатом натрия.
Висмутат натрия NaBiO3 в кислой среде окисляет ионы Mn2+ до перманганат-ионов, окрашивающих раствор в малиновый (фиолетовый) цвет:
2Mn2+ + 5NaBiO3 + 14H+ → 2MnO4- + 5Bi3+ + 5Na+ + 7H2O
Выполнение реакции:
1 каплю раствора соли марганца(II) помещают в коническую пробирку, добавляют 3-4 капли 6 М раствора азотной кислоты и 5-6 капель воды, после чего вносят в раствор с помощью стеклянной лопатки немного порошка NaBiO3. После перемешивания центрифугируют избыток висмутата натрия и наблюдают малиновую (фиолетовую) окраску центрифугата.
ВНИМАНИЕ!!! При выполнении этой и следующей реакции не следует брать для реакции много раствора соли марганца(II), так как в этом случае избыточные ионы Mn2+, не вступившие в реакцию с висмутатом натрия, будут взаимодействовать с перманганат-ионами по реакции
3Mn2+ + 2MnO4- + 7H2O → 5MnO(OH)2↓ + 2H+
и малиновая окраска исчезнет. По той же причине в растворе не должно быть никаких других восстановителей и, в частности Cl- ионов, так как они тоже восстанавливают MnO4- до MnO(OH)2 или даже до Mn2+:
2MnO4- + 16H+ + 10Cl- → 2Mn2+ + 8H2О + 5Cl2↑
4. Окисление двуокисью свинца PbО2.
Выполнение реакции:
Берут стеклянной лопаткой немного порошка PbО2 и помещают в пробирку, прибавив туда же 4-5 капель 6н. раствора HNO3; нагревают. Через 1-2 мин. центрифугируют и, не отделяя осадка, рассматривают окраску раствора. Если она малиново—фиолетовая (цвет MnO4-), реактивы содержат марганец и для опыта не годятся. При отсутствии окраски прибавляют в ту же пробирку со смесью HNO3 и PbO2 1 каплю исследуемого на Mn2+ раствора, не содержащего Cl- - ионов [MnSO4 или Mn(NO3)2], перемешивают и снова нагревают. При этом Мn2+ окисляется до марганцовой кислоты НMnО4, имеющей характерную малиново-фиолетовую окраску:
2Mn2+ + 5PbO2↓ + 4H+ → 2MnO4- + 5Pb2+ + 2H2O
5. Едкие щелочи NaOH и КОН образуют с Mn2+ белый осадок Mn(ОН)2, растворимый в кислотах, но нерастворимый в щелочах:
Mn2+ + 2ОH- → Mn(ОН)2↓
Осадок быстро буреет на воздухе вследствие окисления Mn2+ до марганца (IV), т.е. вследствие образования марганцовистой кислоты MnO(OH)2 (или H2MnO3). Если, кроме щелочи, подействовать на соль марганца (II) окислителем (перекисью водорода или бромной водой), то MnO(OH)2 образуется сразу, выпадая в виде темно-бурого осадка:
Mn2+ + 2ОH- + H2O2 → MnО(ОН)2↓ + H2O
В отличие от Mn(ОН)2 осадок MnО(ОН)2 нерастворим в разбавленной серной кислоте. Если, однако, кроме серной кислоты прибавить 1-2 капли раствора пероксида водорода, то произойдет растворение (испытайте!). В этих условиях (т.е. в кислой среде) Н2О2 действует на MnIV как восстановитель, окисляясь до свободного кислорода:
MnО(ОН)2↓ + 2Н+ + H2O2 → Mn2+ + 3H2O + О2↑