Лабораторные работы по теме: Потенциометрическое титрование
1. Лабораторная работа. Определение содержания хлороводородной и борной кислот при совместном присутствии методом потенциометрического титрования
Потенциометрическое титрование
Оглавление
- Теоретическая часть
- Экспериментальная часть
- 1. Методика выполнения работы
- 2. Обработка результатов анализа
Теоретическая часть
Потенциометрическое определение концентрации водородных ионов или величины рН основано на измерении электродного потенциала, возникающего при погружении электродов в анализируемый раствор.
Измерение электродного потенциала осуществляется с помощью систем, состоящих из двух электродов. Один из них - индикаторный (стеклянный, платиновый) электрод - чувствителен к ионам, присутствующим в растворе, и потенциал, возникающий на нем, зависит от концентрации ионов в анализируемом растворе. Другой электрод - электрод сравнения (каломельный или хлорсеребряный) - не чувствителен к ионам раствора и потенциал его постоянен.
При погружении в раствор стеклянного электрода, представляющего собой тонкослойный шарик из литиевого стекла, происходит обмен ионами между раствором и поверхностью шарика. Ионы лития проникают из стекла в раствор, а ионы водорода - из раствора в стекло. На поверхности стеклянного электрода устанавливается потенциал, величина которого определяется концентрацией водородных ионов.
Титрование хлороводородной кислоты в борной (К(Н3ВО3)=10-7; рК (Н3ВО3)=9,24) осуществляется с большой точностью.
Борную кислоту по кислотно-основному методу оттитровать непосредственно нельзя из-за малой величины константы диссоциации. Однако, если к раствору после завершения титрования хлороводородной кислоты прибавить соответствующий лиганд (манит, глицерин и т.д.), усиливающий кислотные свойства борной кислоты (при этом борная кислота образует комплексную борно-глицериновую (борноманнитовую) кислоту, обладающую относительно большой константой диссоциации (Ка = 10-5)), то ее можно определить количественно.
Экспериментальная часть
Цель работы: Ознакомиться с методом потенциометрического титрования; по результатам титрования вычислить массу навесок хлороводородной и борной кислот в анализируемом растворе.
Оборудование и реактивы:
рН-метр, электромагнитная мешалка, штатив, бюретка, 2 сосуда для титрования;
0,1000 М раствор NaOH, глицерин, растворы HCl и H3BO3 с молярной концентрацией эквивалента 0,1 моль/л.
Методика выполнения работы
Включить рН-метр. Промыть электрод и магнитную мешалку дистиллированной водой и просушить фильтровальной бумагой. Налить в сосуд для титрования раствор борной кислоты Н3ВО3 такое количество, чтобы шарик из литиевого стекла был погружен в раствор. Погруженный с сосуд электрод не должен доходить до дна на 4-6 мм. После того как показания примут устойчивые значения, записать в журнале величину рН раствора кислоты.
рН1 =
Найденная величина рН показывает, что в случае титрования смеси НСI и Н3ВО3 до достижения этого значения рН, борная кислота еще не вступает в реакцию со щелочью.
Затем в сосуд для титрования с раствором Н3ВО3 добавить 5 мл глицерина. Смесь размешать на магнитной мешалке. Измерить рН2
рН2 =
(Почему и как изменилось значение рН2 по сравнению с рН1?)
Промыть и просушить фильтровальной бумагой магнитную мешалку. Промыть электроды 2-3 раза дистиллированной водой и просушить фильтровальной бумагой.
Получить задачу для анализа. Долить содержимое сосуда, если нужно, дистиллированной водой, чтобы стеклянный шарик из литиевого стекла был погружен в этот раствор. Положить мешалку, перемешать магнитной мешалке. Определить рН.
Провести ориентировочное титрование. Для этого к содержимому в титрационный сосуд прибавить 1 мл NaOH. Перемешать. Определить рН… и так до тех пор, пока не обнаружится первый скачок рН, отвечающий оттитрованию НСI. Данные записать в таблицу 1.
Затем к раствору прибавить 5 мл глицерина. Перемешать до полного растворения. Продолжать титрование с градиентом приливания 1 мл до обнаружения второго резкого скачка рН, соответствующего значению рН конца титрования бороглицериновой кислоты. Данные ориентировочного титрования записать в таблицу:
Таблица 1
|
Объем NaOH, мл |
рН |
|
0 |
|
|
1 |
|
|
2 и т.д. |
|
По результатам ориентировочного титрования определите скачки рН, отвечающие оттитровыванию HCl и H3BO3.
Затем выполняют точное титрование анализируемого раствора (во втором сосуде для титрования) в тех же условиях, с градиентом приливания 0,5 мл в области скачков титрования. Данные записать в таблицу 2.
Таблица 2
|
Объем NaOH, мл |
∆V, мл |
рН |
∆ рН |
∆ рН / ∆V |
|
0 |
|
|
|
|
|
1 |
|
|
|
|
|
2 и т.д. |
|
|
|
|
По данным титрования построить два графика в координатах:
рН ∆ рН/∆ V
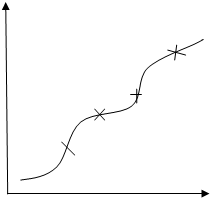
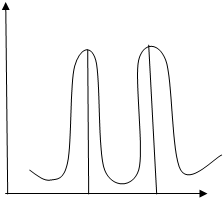
V (NaOH), мл V1 V2 V (NaOH), мл
V1 - Объем щелочи, затраченной на титрование НСI
V2 - Объем щелочи, затраченной на титрование НСI и Н3ВО3
Обработка результатов анализа
Вычисления проводят на основе построенных кривых титрования.
1. По первому скачку рН (V1) найти массу НСI во взятом для титрования объеме:
m (НСI) = V1(NaOH)*C(NaOH)* M(НСI)
2. Найти массу Н3ВО3 (в соответствии с объемом затраченной на титрование щелочи):
m (Н3ВО3) = (V2 (NaOH) - V1 (NaOH))* C(NaOH)* M(Н3ВО3)
По окончании работы электроды промыть 2-3 раза дистиллированной водой и оставить опущенными в стакан с дистиллированной водой. рН-метр и магнитную мешалку отключить от сети.